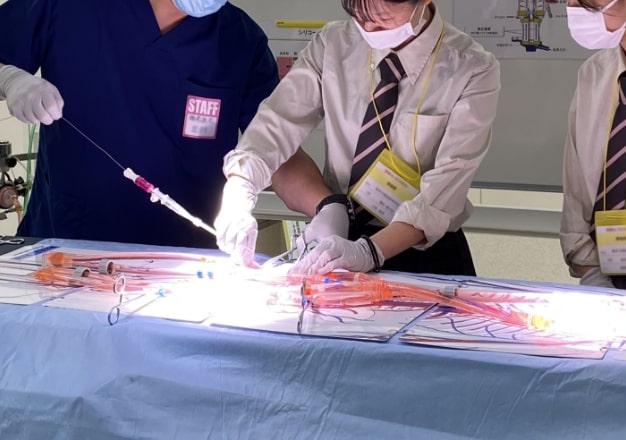
医療機器を使う人・
造る人を育てるトレーニング
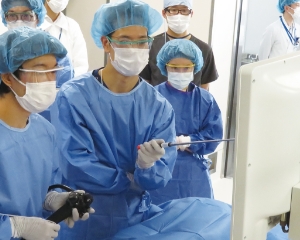
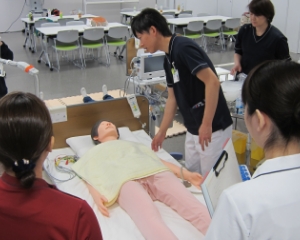
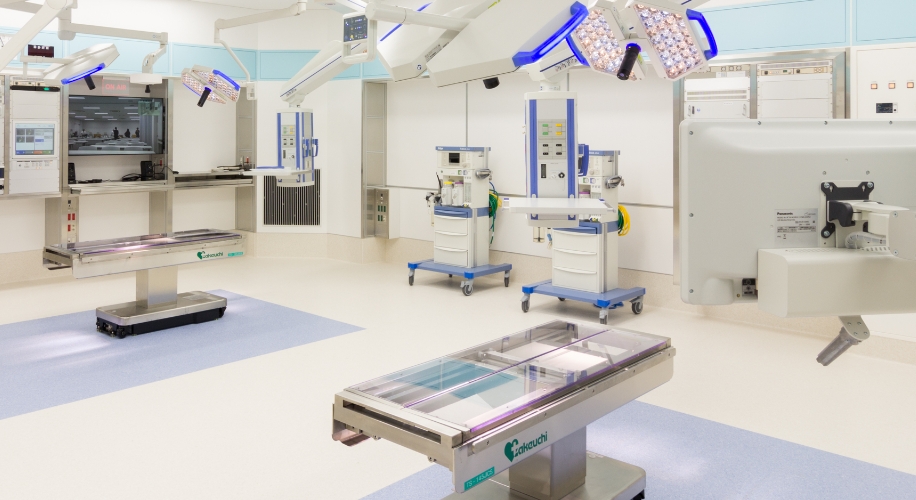
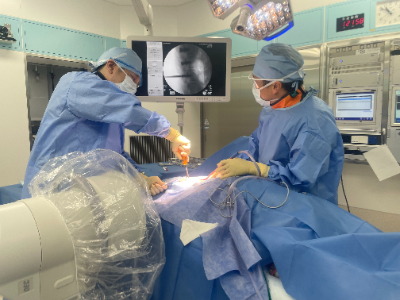
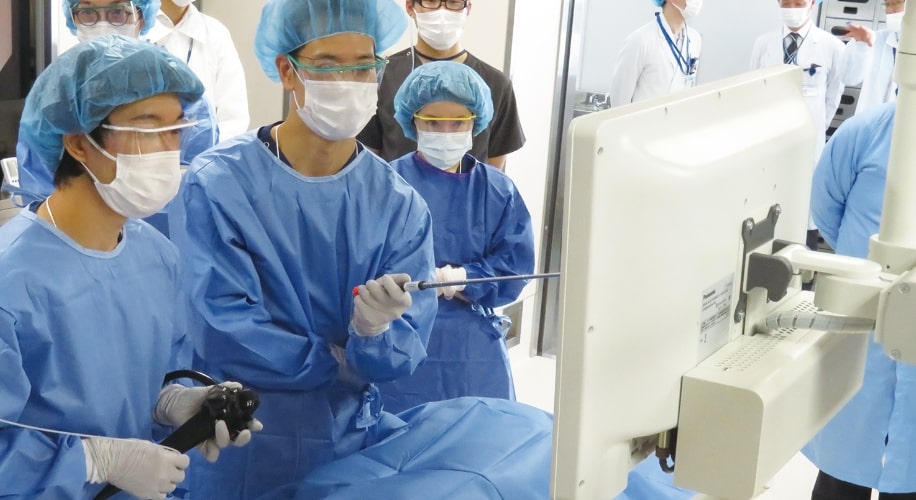
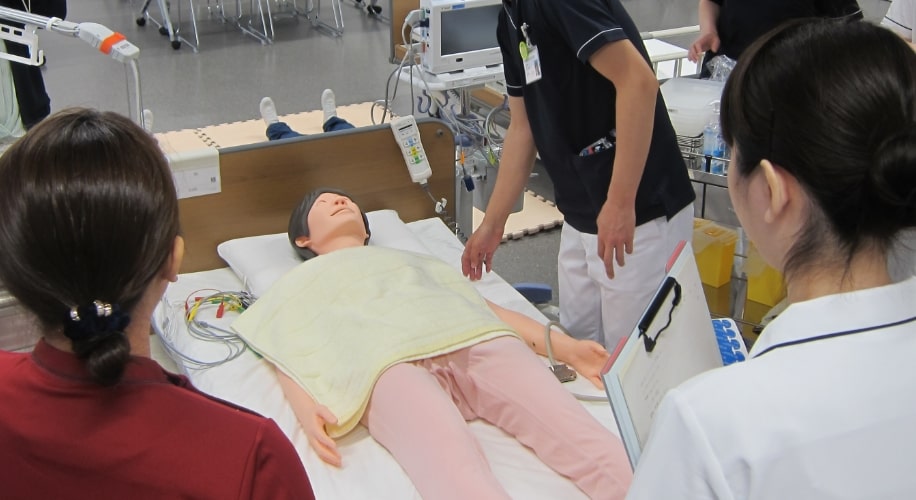
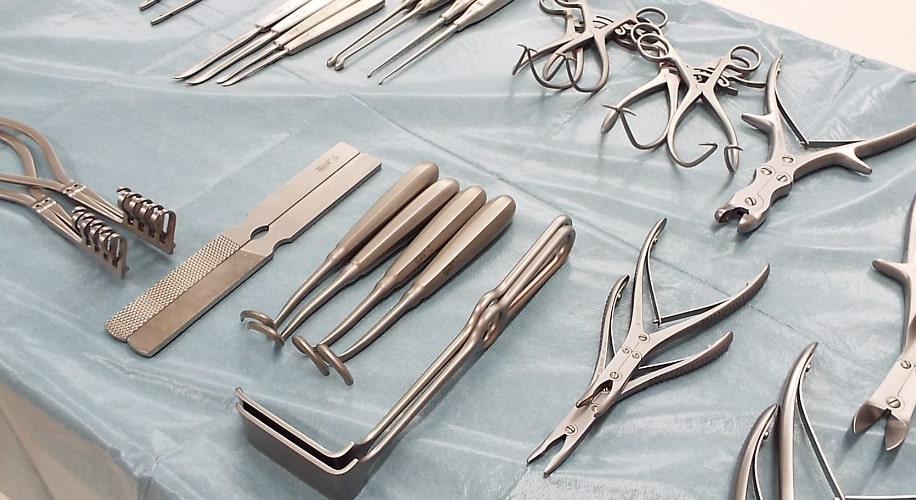
臨床現場に即した環境で医療に貢献する人材の幅広いトレーニングが実施できます。

医療機器開発に
関わる人々をつなぐ
マッチング
メディカルクリエーションふくしまや福島県医療福祉機器産業協議会など、産学官・医工連携の架け橋となるイベントなどを通じ、開発・事業化を支援します。

医療機器開発に必要な
情報を知る
コンサルティング
“新規参入企業”に対する薬事・保険相談、製品のユーザー評価に対応します。
医療関連産業に新規参入を考えている企業を主な対象として、許認可の取得や品質保証体制の構築、保険償還への対応など、必要な情報の提供などを行っています。
さまざまな法規制を遵守しなければならない医療関連産業への参入を考えている多くの企業・団体の方々への個別相談も実施しています。
市場・ニーズの目利き
開発しようとする医療機器の市場性・実現性について、医療関係者や有識者、医療機器メーカーなどとの意見交換の場を提供します。
設計開発・
安全性評価コンサル
開発を始めた医療機器のリスクマネジメントや安全性試験の手法などを、有識者や試験機関職員などが助言指導します。
法令・規格適応コンサル
品目申請などを行う医療機器について、コンサルタントや専門家などにより、申請などの手順や方法、国際規格への対応方法を助言します。
その他
展示会・学会への参加、販路拡大、海外展開などについて、連携業務、広報活動などのアドバイスを行います。
さまざまなステージの医療機器開発をサポート